В постнатальном онтогенезе у телят молозивного периода стремительно изменяется видовой и количественный состав микрофлоры пищеварительной системы.
Интенсивный рост молодняка и усиленный обмен веществ требуют наличия в рационе телят большого количества
питательных компонентов, обеспечивающих трофические функции белков.
Актуальность исследования
Интенсификация животноводства с высокой технологизацией производства молока, а также воздействие на организм животных антропогенных факторов приводят к структурным и функциональным изменениям роста и развития плода у коров [1].
Еще в период внутриутробного развития и прохождения через родовые пути пищеварительный канал плода заселяют микроорганизмы. Новорожденный теленок теряет связь с материнским организмом, что требует чрезвычайного напряжения, связанного с приспособлением к внеутробному существованию. Дальнейшее развитие теленка, функционирование органов и систем его организма, а также резистентность зависят от кормления и условий содержания. Под влиянием раздражающего действия первой порции молозива у теленка активно начинает функционировать пищеварительная система [2], что является одним из факторов формирования естественной резистентности организма и становления его нормальной микрофлоры, которая представлена в основном грамположительными бактериями Lactobacillus, Bifidobacterium и Propionibacterium. Индигенная микрофлора активно конкурирует с потенциальными патогенами, продуцирует биологически активные вещества (витамины, органические кислоты и пр.), стимулируют фагоцитарную активность нейтрофилов и макрофагов, активизирует синтез секреторных иммуноглобулинов, цитокинов и интерферонов [3].
В связи с этим возникает вопрос о видовом и количественном содержании облигатных микроорганизмов в кишечнике и спектре сывороточных иммуноглобулинов у телят, выращиваемых на молочно-товарных фермах, до выпойки первой порции молозива и по окончании молозивного периода. Выяснение данного вопроса и явилось целью настоящей работы.
Условия и материалы исследования
Исследование выполнено на кафедре акушерства, хирургии и незаразных болезней ФГБОУ ВО «Ивановская ГСХА». Объектом для исследования послужили доморощенные телята костромской породы, полученные от коров 3–4-летнего возраста (всего 22 теленка).
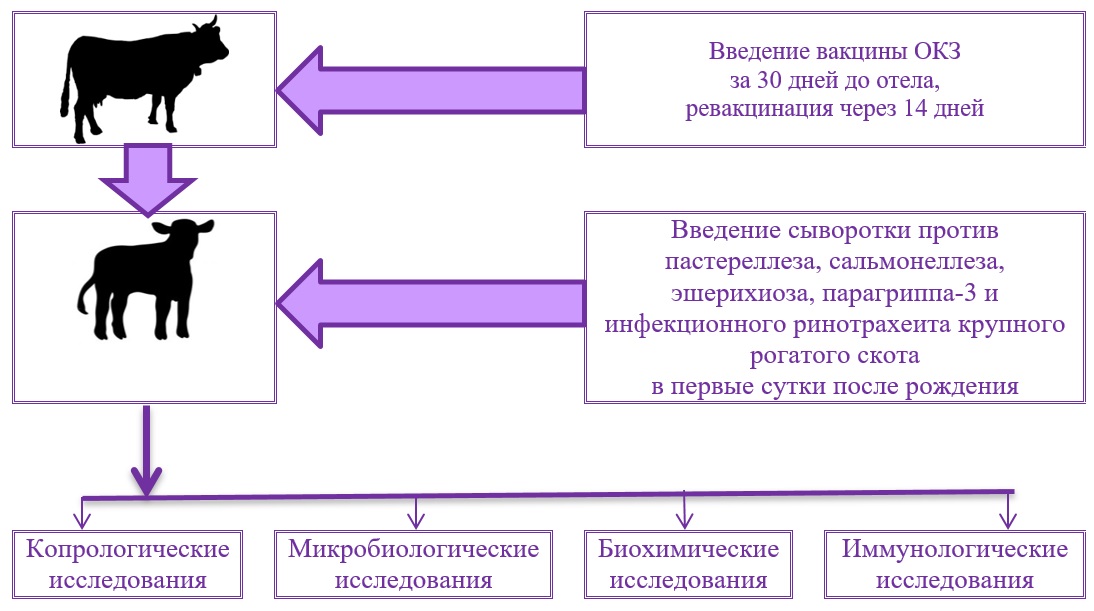
Содержание животных осуществлялось по стандартной технологии, принятой в хозяйстве. Согласно плану ветеринарных мероприятий в хозяйстве всех коров иммунизируют вакциной ОКЗ против колибактериоза, сальмонеллеза, клебсиеллеза и протейной инфекции молодняка сельскохозяйственных животных и пушных зверей (ООО «Агровет», Россия) за 30 дней до отела с последующей ревакцинацией в соответствии с наставлением по применению. Также согласно плану ветмероприятий телятам в течение первых суток жизни вводят сыворотку против пастереллеза, сальмонеллеза, эшерихиоза, парагриппа-3 и инфекционного ринотрахеита крупного рогатого скота в соответствии с инструкцией.
Пробы фекалий для микробиологических исследований отбирали непосредственно из прямой кишки в стерильные контейнеры (FL-medical).
Кровь для биохимических исследований и определения иммуноглобулинов классов A, G и M получали из яремной вены в стерильные пробирки с активатором свертывания. Отбор проб осуществляли в течение двух часов после рождения телят, до выпойки им первой порции молозива, а также на пятые сутки жизни молодняка (по окончании молозивного периода).
Исследование проводили по стандартным методикам. Схема исследования представлена ниже.
Результаты исследования
В раннем постнатальном периоде развития организм телят еще недостаточно сформирован, но тем не менее сразу же после рождения у них наблюдается отхождение мекония, свойства которого значительно отличаются от копрологических показателей молодняка в последующем.
У новорожденных телят первородный кал без выраженного запаха, кислой рН, густой консистенции, с незначительной примесью волос. При микроскопии нативных мазков в 50 % случаев выявлена слизь в незначительном количестве; встречаются эритроциты и лейкоциты (до 5–7 клеток в поле зрения) и единичные клетки кишечного эпителия; в равном соотношении – кокковая и палочковидная микрофлора; йодофильная флора представлена палочковидными формами в единичных экземплярах. В окрашенных мазках также обнаружены нейтральные жиры (в 70 % мазков – в умеренном количестве, в 30 % мазков – в большом и очень большом) и крахмал (до 10–15 зерен) [6].
Оценивая оккупацию кишечника облигатной микрофлорой, мы установили, что у новорожденных телят присутствуют бифидо- и лактобактерии, кишечная палочка с нормальной ферментативной активностью и энтерококки в количестве 106 КОЕ/г; 104 КОЕ/г; 102 КОЕ/г и 104 КОЕ/г соответственно.
Исследование биохимических показателей сыворотки крови у новорожденных телят показало, что уровень содержания глюкозы составил 4,87 ±0,15 ммоль/л; уровень содержания триглицеридов – 0,17 ±0,02 ммоль/л; уровень содержания холестерола – 1,07 ±0,17 ммоль/л; уровень содержания общего белка – 67,50 ±3,91 г/л (в том числе альбумин – 34,70 ±1,64 г/л и глобулины – 32,83±2,56 г/л). При этом следует отметить, что концентрация иммуноглобулина G составила 38,23 %, концентрация иммуноглобулина M – 8,07 %, концентрация иммуноглобулина А – 0,97 %. Концентрация иммуноглобулина G у новорожденных животных не отличается от таковой у взрослых, присутствие иммуноглобулинов других классов объясняется антигенной стимуляцией коров-матерей, так как все вакцинные препараты в той или иной степени являются иммуностимуляторами [4, 5].
По окончании молозивного периода согласно технологии, принятой в хозяйстве, у пятисуточных телят также были выполнены аналогичные исследования. Кал у телят имел цвет от светло-желтого до охристо-коричневого, запах – от кисловатого до кислого, консистенция в 70 % случаев была мазевидной, а в 30 % случаев – линиментообразной, рН – щелочная. На поверхности кала в 100 % проб определялась слизь в умеренном количестве, имелись эритроциты, но их было в 2–3 раза меньше, чем у новорожденных телят. Количество лейкоцитов увеличилось до 10 клеток в поле зрения.
В большом количестве выявлялись клетки кишечного эпителия. Во всех пробах обнаружены нейтральные жиры в очень большом количестве и единичные зерна крахмала. В большом количестве присутствовала йодофильная палочковидная микрофлора, в 30 % проб флора была кокковой. Установлено, что у пятисуточных телят в кишечнике увеличивается концентрация лактобактерий, бифидобактерий, кишечной палочки с нормальной ферментативной активностью и энтерококков до 106 КОЕ/г; 108 КОЕ/г; 106 КОЕ/г и 105 КОЕ/г соответственно. Кроме того, появляются клостридии, уровень содержания которых не превышает 103 КОЕ/г. Эти микроорганизмы являются для крупного рогатого скота представителями нормальной микрофлоры [7].
Биохимические показатели свидетельствовали о незначительном снижении концентрации глюкозы, которое компенсировалось увеличением концентрации триглицеридов и холестерола. Уровень содержания белка у пятисуточных телят составил 61,50 ±0,34 г/л, наблюдалось повышение белкового коэффициента за счет снижения уровня содержания глобулинов. Тем не менее концентрация иммуноглобулинов G, M и A достоверно увеличилась и достигла, соответственно, 44,03 %; 9,06 % и 1,09 %.
Заключение
Проведенное исследование показало, что в раннем постнатальном онтогенезе изменение показателей микробного пейзажа пищеварительного тракта, биохимических и иммунологических показателей крови происходит стремительно и во многом зависит от ветеринарных мероприятий, проводимых в хозяйстве. Большое значение для пищеварения и резистентности телят имеет резидентная микрофлора, которая при выпойке молозива активно заселяет желудочно-кишечный тракт и стимулирует иммунную защиту, которая проявляется повышением уровня содержания иммуноглобулинов.
Оценка динамики физико-химических показателей кала, кишечного биоценоза, биохимических показателей сыворотки крови и концентрации иммуноглобулинов у новорожденных животных и достигшего пятисуточного возраста молодняка дает возможность целенаправленно проводить коррекцию кормления и содержания коров-матерей и новорожденных телят с целью повышения их сохранности и формирования дальнейшей продуктивности.
Авторы:
Н. Н. Якименко, кандидат ветеринарных наук, доцент, Федеральное государственное бюджетное образовательное учреждение высшего образования «Ивановская государственная сельскохозяйственная академия имени Д. К. Беляева» (ФГБОУ ВО «Ивановская ГСХА»), Иваново
М. С. Маннова, кандидат биологических наук, доцент, ФГБОУ ВО «Ивановская ГСХА», Иваново
Л. В. Клетикова, доктор биологических наук, профессор, ФГБОУ ВО «Ивановская ГСХА», Иваново
Д. И. Синельщикова, аспирант, ФГБОУ ВО «Ивановская ГСХА», Иваново
Н. П. Шишкина, студентка 5-го курса факультета ветеринарной медицины
и биотехнологии в животноводстве, ФГБОУ ВО «Ивановская ГСХА», Иваново
Библиографические ссылки
1. Баймишев Х. Б. Морфологические показатели органов гемоиммунопоэза новорожденных телят // Ученые записки Казанской государственной ветеринарной академии им. Н. Э. Баумана. 2014. Т. 217, № 1. С. 26–32.
2. Динамика копрологических показателей у клинически здоровых телят в период новорожденности / М. С. Маннова, Н. Н. Якименко, Н. П. Шишкина, Л. В. Клетикова // Современная научная мысль : материалы VI Всероссийской научно-практической конференции, Чебоксары, 5 февр. 2020 г. Чебоксары, 2020. С. 233–240.
3. Ерина Т. А. Микробиоценоз кишечника и иммунный статус новорожденных телят с разным морфофункциональным развитием и их коррекция : автореф. дис. … канд. вет. наук. Курск, 2015. 20 с.
4. Романцов М. Г., Ершов Ф. И. Часто болеющие дети: современная фармакотерапия. Москва : ГЕОТАР-Медиа, 2016. 188 с.
5. Хаитов Р. М., Пинегин Б. В., Истамов Х. И. Экологическая иммунология. Москва : ВНИРО, 1995. 219 с.
6. Mannova M. S., Kletikova L. V., Yakimenko N. N. Dynamics of the coprogram in calves in the age aspect against the background of the use of enterosorbent // Scientific research of the SCO countries: synergy and integration. Reports in English Materials of the International Conference (18.03.2020. Beijing, PRC). China, Beijing, 2020. Р.100–106.
7. Petit L., Gibert M., Popoff M. Clostridium perfringens: toxinotype and genotype // R. Trends in Microbiology. 1999. Vol. 7. P. 104–110.

