Эпидемическая обстановка по бруцеллезу в Российской Федерации продолжает оставаться напряженной. Выявляются новые неблагополучные пункты даже в ранее благополучных по бруцеллезу крупного рогатого скота субъектах РФ и сохраняется опасность заражения бруцеллезом как животных, так и человека. У возбудителя определяется до 15 поверхностных антигенных фракций, основным из которых является липополисахарид LPS. Структура антигена LPS у штаммов бруцелл образует шероховатые (R-LPS) и гладкие (S-LPS) колонии.
Иммунитет при бруцеллезе в основном клеточный и формируется как гиперчувствительность замедленного типа. Образование специфических иммуноглобулинов (Ig A, Ig M, Ig G) имеет определенную закономерность. Фагоцитоз бруцелл клетками макрофагальной системы носит незавершенный характер, угнетая адгезивные способности нейтрофилов и снижая показатели кислородозависимой системы бактерицидной активности. Способность бруцелл длительно выживать внутри фагоцита является основной причиной «несостоятельности» противобруцеллезных гуморальных факторов защиты. Полученные авторами результаты указывают на необходимость постоянного эпизоотологического и иммунологического наблюдения за заражением бруцеллезом животных и людей.
В настоящее время одним из основных направлений деятельности ветеринарных служб является эпизоотологический мониторинг как один из главных инструментов контроля и ликвидации особо опасных болезней животных. Повышенное внимание уделяется эпизоотической обстановке в регионах Российской Федерации с целью защиты населения, так как более 80 % инфекционных заболеваний являются общими для человека и животных.
В докладе Комитета Совета Федерации по аграрно-продовольственной политике и природопользованию неоднократно выражалась озабоченность угрозой заноса антропозоонозных инфекций в благополучные регионы нашей страны (Москва, 14 июня 2017 года).
По данным Объединенного комитета экспертов ВОЗ до сих пор одним из социально значимых заболеваний является бруцеллез. Заболевание это широко распространено практически во всем мире, в том числе в таких развитых странах, как США, Франция, Канада, Австралия, Италия, Испания [4]. Эпидемическая обстановка по бруцеллезу в Российской Федерации в течение длительного времени остается напряженной и определяется сохраняющимися эпизоотиями бруцеллеза у сельскохозяйственных животных (мелкого и крупного рогатого скота), которые являются основными источниками инфекции для людей [6, 7, 23, 30].
Чаще всего бруцеллез регистрируется в регионах с высокой животноводческой ориентацией сельского хозяйства: в Карачаево-Черкесской Республике 58 неблагополучных пунктов по бруцеллезу крупного рогатого скота; в Республике Северная Осетия – Алания – 19; в Республике Дагестан – 16; в Ставропольском крае – 13; в Самарской области – 10. Последние годы выявляются новые неблагополучные пункты даже в ранее благополучных по этому заболеванию субъектах РФ [10].
Оздоровление хозяйств от бруцеллеза крупного рогатого скота проводится с использованием комплекса мероприятий, включающих выбраковку реагирующих животных и одновременное создание иммунной защиты с применением противобруцеллезных вакцин. Ежегодно в нашей стране вакцинируется и ревакцинируется против бруцеллеза 5,0 млн голов скота и свыше 20,0 млн голов сельскохозяйственных животных исследуется на бруцеллез с диагностической целью [5].
В Уральском регионе оздоровление племенных и товарных хозяйств от бруцеллеза велось на протяжении нескольких десятков лет, и сегодня Свердловская область благополучна по бруцеллезу сельскохозяйственных животных. Однако острой проблемой остаются внешние эпидемиологические и эпизоотологические риски, связанные с импортом в Свердловскую область в рамках Евразийского экономического сотрудничества животных и животноводческой продукции из республик Армения, Казахстан и Киргизия, являющихся эндемичными по бруцеллезу крупного и мелкого рогатого скота [3, 17, 30]. Кроме того, территориально Свердловская область граничит с неблагополучными по бруцеллезу животных областями и административными округами (рис. 1).
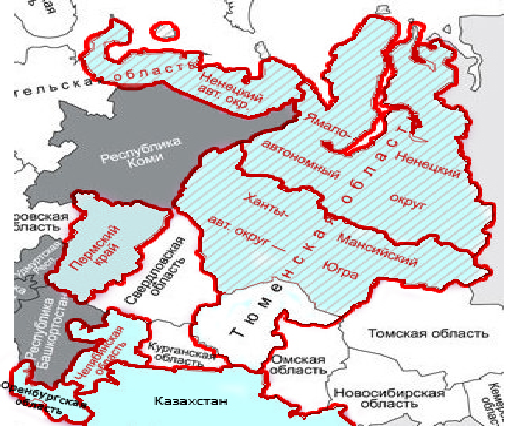
Рис. 1. Эпизоотическая ситуация по бруцеллезу сельскохозяйственных животных в Уральском федеральном округе в 2016–2017 гг. по данным Министерства сельского хозяйства Российской Федерации за 2017 г. [5]. Голубым цветом выделены неблагополучные по бруцеллезу сельскохозяйственных животных субъекты
Так, в 2016 г. Челябинская область являлась неблагополучной по бруцеллезу крупного и мелкого рогатого скота; Ханты-Мансийский автономный округ – по бруцеллезу крупного и мелкого рогатого скота и бруцеллезу оленей; Пермский край и Ямало-Ненецкий автономный округ – по бруцеллезу оленей [5, 23]. В настоящее время риск инфицирования как населения, так и сельскохозяйственных животных возбудителем бруцеллеза продолжает оставаться объективно высоким [12, 13, 28].
Несмотря на интенсивное изучение бруцеллеза, механизмы развития этого инфекционного заболевания остаются недостаточно выясненными и у человека, и у животных, что определяет необходимость более углубленного изучения его патогенеза и иммуногенеза.
Возбудители бруцеллеза – аэробные неподвижные внутриклеточные грамнегативные коккобациллы рода Brucella, по международной классификации состоящие из 9 самостоятельных видов: Вr. abortus (крупный рогатый скот, яки, буйволы); Вr. melitensis (овцы, козы); Br. suis (свиньи); Вr. canis (собаки); Br. ovis (овцы, бараны); Br. neotomae (крысы, мыши и другие грызуны); Br. ceti (китообразные); Br. pinnipedialis (ластоногие); Br. microti (полевка обыкновенная).
Бруцеллы характеризуются выраженным полиморфизмом: в одной биопробе обнаруживаются как кокки, так и удлиненные палочки (рис. 2).
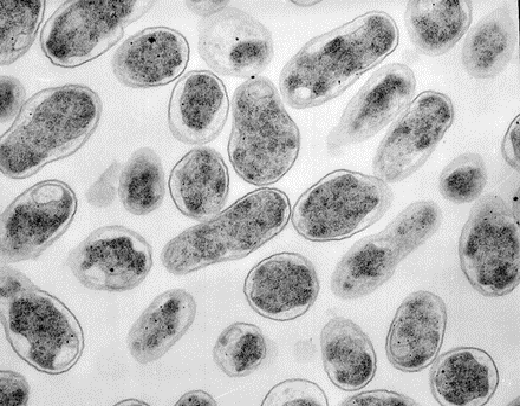
Рис. 2. Возбудитель Brucella abortus крупного рогатого скота. Окраска по Граму [18]
У возбудителя определяется до 15 поверхностных антигенных фракций, в которых выделяют родовой антиген и видовые поверхностные антигены. Основным поверхностным антигеном, индуцирующим синтез антител, является липополисахарид LPS. Структуры поверхностного антигена LPS у штаммов бруцелл, образующих шероховатые (R-LPS) и гладкие (S-LPS) колонии, сходны между собой [6].
В природе в естественных условиях в основном встречаются бруцеллы в S-форме. Помимо этих типичных вариантов под воздействием неблагоприятных физических, химических и иммунобиологических факторов бруцеллы образуют измененные варианты – R, М (мукоидная) и МБВ (минус-вариант по поверхностному антигену бруцелл) формы.
К наиболее измененному варианту бруцелл относятся L-формы. Они имеют специфическую антигенную структуру и специфический метаболизм и принципиально отличаются от других форм, в том числе и от дегенерирующих МБФ-форм – последней стадии диссоциации бруцелл, когда еще сохраняется стенка микробной клетки. Степень диссоциации микробов определяется утратой их способности к агглютинации, т. е. утратой поверхностно-оболочечного S-антигена [6, 9, 14, 22].
Длительная персистенция L-форм бруцелл в организме и способность их к реверсии обуславливают хронически-рецидивирующее течение болезни. Инфицирование микроорганизмами L-формы ведет к формированию первично-латентной формы L-бруцеллезного инфекционного процесса. Так, Т. А. Макарова с соавторами (1975) обнаружила L-формы бруцелл через 19 лет после начала болезни. Нужно, однако, отметить, что, несмотря на достигнутые успехи в изучении L-форм бруцелл, многие их особенности требуют дальнейшего внимания исследователей [15, 20, 26].
Установлено, что бруцеллы продуцируют ферменты гиалуронидазу и нейраминидазу, которые разрушают мукополисахариды на поверхности эпителиальных клеток, что способствует проникновению возбудителей бруцеллеза через барьеры кожных покровов и слизистых оболочек респираторного и желудочно-кишечного тракта и половых путей [2, 14]. Прошедший через эпителиальный барьер возбудитель попадает в кровь и/или в лимфу, откуда мигрирует в близлежащий лимфоузел и/или в ретикулоэндотелий органов. Далее активизируется макрофагальная система, и в органах и тканях происходят диффузные изменения с очаговыми скоплениями лейкоцитарных клеток [12, 13, 29, 32].
Если вирулентность возбудителя и его доза относительно невелики, то при нормальном состоянии иммунной системы животного бруцеллы из организма элиминируются. Инфекционный процесс в этом случае прекращается в самой начальной своей стадии, а у животного формируется относительный иммунитет. Положительные серологические или аллергические реакции на бруцеллез «угасают» в течение 6 месяцев [1, 12, 14, 15].
Иммунитет при бруцеллезе в основном клеточный и формируется с развитием аллергических реакций, характерных для гиперчувствительности замедленного типа. В динамике образования специфических иммуноглобулинов, таких как Ig A, Ig M, Ig G, прослеживается определенная закономерность. Интенсивный синтез иммуноглобулинов и высокая сероконверсия специфических антител к бруцеллезу регистрируются в начальном периоде болезни. При хронизации инфекционного процесса отмечается снижение концентрации специфических иммуноглобулинов, и противобруцеллезные антитела выявляются в более низких титрах, чем в начале заболевания [12, 17, 20, 21, 31].
Изменения в интенсивности иммунного ответа происходят в результате нарушения индуцирования его гуморального звена. Фагоцитоз бруцелл клетками макрофагальной системы носит незавершенный характер (рис. 3).
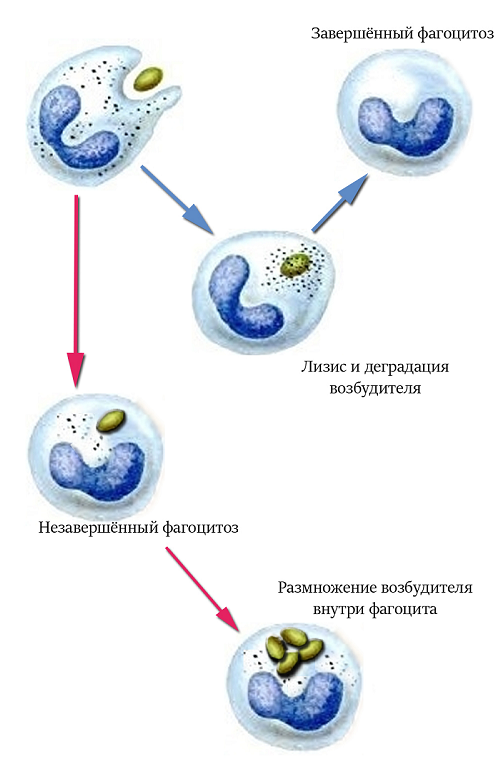
Рис. 3. Особенности фагоцитоза при бруцеллезе крупного рогатого скота
В многочисленных исследованиях было показано, что одной из причин незавершенного фагоцитоза является угнетение адгезивной способности нейтрофилов и снижение у них показателей кислородозависимой системы бактерицидной активности [8, 11, 21, 24, 25, 27]. У больных бруцеллезом животных формируется антигенспецифическая депрессия фагоцитоза.
Способность бруцелл супрессировать основные функции бактерицидной системы макрофагальных клеток позволяет им не только длительно выживать внутри фагоцита, но и «укрываться» от бактерицидного действия лизоцима и комплемента плазмы крови. По мнению ряда авторов, антигенспецифическая депрессия фагоцитоза является основной причиной «несостоятельности» противобруцеллезных гуморальных факторов защиты [4, 12, 16, 17, 24].
Таким образом, патогенетические особенности бруцеллеза и определяют его особое положение среди других антропозоонозных инфекционных болезней. Во-первых, это заболевание высококонтагиозное в силу высокой инфицирующей способности бруцелл, что представляет большую угрозу для здоровья человека и животных. Во-вторых, устойчивость микроорганизмов к неспецифическим факторам защиты и их способность паразитировать в клетках иммунной системы приводят к развитию иммунопатологических состояний, при которых инактивирующая роль противобруцеллезных антител ничтожно мала.
Заключение
Бруцеллез представляет собой мировую проблему и для здравоохранения, и для животноводческой отрасли сельского хозяйства в целом и стоит на первом месте в ряду причин профессиональных заболеваний. Прямая или косвенная передача инфекции от зараженных животных человеку приводит к заболеванию, инвалидности и потере трудоспособности [4, 6, 7, 9, 23, 25, 28, 30].
В Российской Федерации достигнуты значительные успехи в борьбе с бруцеллезом животных. Однако в последние годы эпидемиологическая обстановка по бруцеллезу характеризуются как неустойчивая, отмечено ухудшение эпизоотологической ситуации по бруцеллезу крупного рогатого скота в регионах с развитым животноводством [5, 10]. Прогноз развития эпизоотической ситуации по бруцеллезу в современных экономических условиях в среднесрочной перспективе неблагоприятный [23, 30].
По данным Россельхознадзора, существует реальный риск широкого распространения бруцеллеза у сельскохозяйственных животных в субъектах Центрального и Приволжского федеральных округов [19, 23].
Аналитический обзор литературных данных выполнен в рамках направления 160 программы ФНИ государственных академий наук на 2013–2020 гг. по теме «Разработка теоретических основ для создания и внедрения программы мониторинга, диагностики, лечебно-профилактических и оздоровительных мероприятий по защите животных от эпизоотически значимых инфекционных болезней».
Авторы:
С. В. Малков, кандидат ветеринарных наук, старший научный сотрудник отдела экологии и незаразной патологии животных ФГБНУ «Уральский федеральный аграрный научно-исследовательский центр Уральского отделения Российской академии наук», Екатеринбург
Л. С. Ваганова, аспирант, младший научный сотрудник отдела экологии и незаразной патологии животных ФГБНУ «Уральский федеральный аграрный научно-исследовательский центр Уральского отделения Российской академии наук», Екатеринбург
Библиографические ссылки
1. Абдрашитова А. Н., Ильясова З. З. Бруцеллез крупного рогатого скота // Материалы V Междунар. студ. электрон. науч. конф. «Студенческий научный форум», РАЕ, 15 февраля – 31 марта 2013 г. URL: http://www.scienceforum.ru/2013/214/4631(дата обращения:10.01.2014).
2. Богомолов Б. П. Инфекционные болезни: неотложная диагностика, лечение, профилактика. М. : Ньюдиамед, 2007. 653 с.
3. Бойбосинов Э. Эпидемия на подходе. Как обезопасить себя от бруцеллеза / ИА Тотал Казахстан, 29 марта 2017 г. URL: https://total.kz/ru/news/ (дата обращения: 09.04.2018).
4. Борисов В. А., Малов И. В., Аитов К. А. Избранные инфекционные заболевания в общей врачебной практике : учеб. пособие. Иркутск, 2009. 230 с.
5. Боровой В. Н. Эпизоотическая ситуация по основным заразным болезням животных в Российской Федерации / М-во сел. хоз-ва РФ. М., 2017. С.14–17.
6. Бруцеллез (клиника, диагностика, лечение, организация медицинской помощи) : метод. пособие для врачей-инфекционистов и врачей общей практики / И. В. Санникова, П. Н. Попов, О. М. Павлова [и др.]. Ставрополь, Изд-во СтГМУ, 2015. 84 с.
7. Васильева Е. В., Ильясова З. З. Бруцеллез – мировая проблема / ФГБОУ ВПО Башкирский ГАУ. Уфа, 2014. С. 1–4.
8. Верещак Н. А. Оценка показателей иммунной системы и методы коррекции иммунной недостаточности у продуктивных животных и птицы в Уральском регионе : дис. … д-ра вет. наук. Екатеринбург, 2007. 304 с.
9. Гордиенко Л. Н. Свойства измененных форм бруцелл, изолированных от северных оленей в очагах «оленьего бруцеллеза» // Материалы междунар. науч. конф. «Эпизоотология, диагностика и профилактика хронических инфекционных болезней животных». Омск, 2003. С. 222–224.
10. Данкверт С. А. Эпизоотические риски и правовые проблемы обеспечения биологической безопасности животноводства России // Аналитический вестник. 2017. № 17 (674). С. 19–25.
11. Донник И. М., Смирнов П. Н. Экология и здоровье животных. Екатеринбург, 2001. 331 с.
12. Дроздова Л. И., Кундрюкова Л. И. (два автора у одной диссертации?!) Иммуноморфогенез бруцеллезного вакцинного процесса в системе мать – плод : автореф. дис. … д-ра вет. наук. Казань, 1986. 44 с.
13. Дроздова Л. И., Плешакова В. И., Колчина А. Ф. Патоморфология плацентарного барьера животных / М-во сел. хоз-ва РФ, ФГОУ ВПО «Уральская государственная сельскохозяйственная академия». Екатеринбург, 2011. 245 с.
14. Инфекционные болезни и эпидемиология / В. И. Покровский, С. Г. Пак, Н. И. Брико, Б. К. Данилкин. М. : ГЭОТАР-Мед, 2004. 832 с.
15. Косилов И. А. Бруцеллез сельскохозяйственных животных / Сиб. отд-ние РАСХН. Новосибирск, 1992. 260 с.
16. Кулжанова Ш. А. Показатели гуморального иммунитета у больных бруцеллезом // Медицинская иммунология. 2010. Т. 12, № 1/2. С. 143–146.
17. Курманова К. Б., Дусейнова А. К. Бруцеллез. Клинические аспекты. Алматы : Kiтап, 2002. 352 с
18. Лечение бруцеллеза в медицинском центре «Триэссто» / Медицинский центр «Триэссто». М., 2018. URL: http://medicinskiy-center.ru/lechenie-brucelleza.html (дата обращения: 09.04.2018).
19. Особенности иммунологических показателей крови у больных различными формами бруцеллеза / О. В. Логвиненко, Е. Л. Ракитина, Д. Г. Пономаренко [и др.] // Инфекция и иммунитет. 2013. Т. 3. С. 275–278.
20. Обзор эпидемиологической ситуации по бруцеллезу в Российской Федерации в 2015 г. и прогноз на 2016 г. / Г. И. Лямкин, Д. Г. Пономаренко, А. А. Худолеев [и др.] // Проблемы особо опасных инфекций. 2016. № 2. С. 11–13.
21. Оценка иммунного статуса и дифференцированная иммунокоррекция при бруцеллезе : метод. рекомендации. Алматы, 2002. 30 с.
22. Ощепков В. Г., Гордиенко Л. Н. L-трансформация бруцелл – значение в эпизоотическом процессе и эволюции рода Brucella // Ветеринарная патология. 2004. № 4. С. 36–46.
23. Пономаренко Д. Г., Русанова Д. В., Куличенко А. Н Об эпизоотолого-эпидемиологической ситуации по бруцеллезу в Российской Федерации в 2016 г. и прогноз на 2017 г. // Проблемы особо опасных инфекций. 2017. № 2. С. 23–27.
24. Салмакова А. В. Сравнительное изучение живых вакцин из различных штаммов B. abortus и влияния иммуномодуляторов на их эффективность : дис. … канд. биол. наук. Казань, 2010. 128 с.
25. Смирнов П. Н., Донник И. М. Экологические проблемы ветеринарной медицины Сибири и Урала // Сибирская аграрная наука III тысячелетия. Новосибирск, 2001. С. 120–123.
26. Триленко П. А. Бруцеллез сельскохозяйственных животных. Л. : Колос, 1976. 280 с.
27. Физиологические особенности животных в районах техногенного загрязнения / И. М. Донник, Я. Б. Бейкин, В. С. Портнов, М. И. Барашкин, О. Л. Лоретц, И. А. Шкуратова, А. Г. Исаева, Н. А. Верещак, А. С. Кривоногова // Ветеринария Кубани. 2013. № 1. С. 21–22.
28. Цирельсон И. Е., Желудков М. М. Бруцеллез в России: профессиональные заболевания и трудовой прогноз // Эпидемиология и инфекционные болезни. 2011. № 5. С. 43–47.
29. Цыркунов В. М. Инфекционные болезни и профилактика внутрибольничных инфекций. Минск : Acap, 2012. 848 с.
30. Эпидемическая ситуация по бруцеллезу в Российской Федерации и государствах – участниках Содружества Независимых Государств / Г. И. Лямкин, Д. Г. Пономаренко, А. А. Худолеев, С. В. Вилинская, А. А. Зайцев, А. Н. Куличенко // Инфекционные болезни: новости, мнения, обучение. Город, 2016. С. 68–74.
31. Corbel M. J. Brucellosis in humans and animals. World Health Organization, 2006. 89 p.
32. Pizarro-Cerda J., Moreno E., Gorvel J. P. Invasion and intracellular traffi cking of Brucella abortus in nonphagocytic cells // Microb. Infect. 2000. Vol. 2. P. 829–835.

