Возбудители инфекционных болезней (ИБ) и организм животного образуют своеобразную систему «биоценоза», в которой происходят процессы взаимоадоптации и устанавливается биологическое равновесие «возбудитель ИБ↔хозяин».
Сущность такого равновесия сводится к тому, что в процессе эволюционного развития у возбудителей ИБ изменяются биологические свойства, позволяющие максимально адаптироваться к «условиям существования», а у «хозяина» формируется «система толерантности» к возбудителю ИБ [1]. Понятие устойчивость биологического равновесия «возбудитель ИБ↔хозяин» весьма относительно. Изменение условий существования популяции «хозяев», как правило, приводит к качественным изменениям патогенных свойств возбудителей ИБ [3, 8]. В современных условиях развития животноводческой отрасли естественная резистентность у сельскохозяйственных животных, в том числе и у крупного рогатого скота ослаблена. Основной причиной, по мнению российских и зарубежных исследователей, является селекция пород крупного рогатого скота с высокими продуктивными показателями [6]. В условиях крупных агропромышленных комплексов восприимчивость таких животных возрастает не только к возбудителям ИБ, но и к микроорганизмам-сапрофитам [2, 9].
В свете фундаментальной ветеринарной науки инфекционные болезни крупного рогатого скота трактуются как паразитоценозы. «…Паразитоценоз – это совокупность прионов, вирусов, микроорганизмов, зоопаразитов и других компонентов биоты, обитающих внутри и на покровах макроорганизма, являющегося их хозяином, и наносящих ему разной степени выраженности вред…» [1]. Поэтому лечебно-профилактические и оздоровительные мероприятия по защите сельскохозяйственных животных от инфекционных болезней не могут быть достаточно эффективными и гарантировать эпизоотическое благополучие без постоянного изучения и анализа структуры паразитоценозов, механизмов сочетанного воздействия компонентов паразитоценоза на организм «хозяина» [10].
Для Уральского региона в настоящее время одной из актуальных проблем ветеринарной науки и практики является создание и внедрение программ лечебно-профилактических и оздоровительных мероприятий по защите сельскохозяйственных животных от острых респираторных инфекционных болезней на территориях с напряженной экологической обстановкой [6]. Как известно, возбудители острых респираторных вирусных инфекций (ОРВИ) обладают способностью индуцировать иммуносупрессивное и иммунодефицитное состояние организма, играют роль основного кофактора в развитии патологии не только дыхательной, но и репродуктивной, и сердечнососудистой систем [8]. В многочисленных исследованиях было показано, что ОРВИ крупного рогатого скота в 95 % случаев протекают как ассоциативные болезни – в сочетании с возбудителями ОРВИ диагностируются вирусы, бактерии, простейшие, гельминты [1, 2]. Такие ассоциативные болезни имеют тяжелое течение, лечение животных сопряжено со значительными экономическими затратами и часто не эффективно [3, 6].
Для сохранения популяционного здоровья сельскохозяйственных животных и обеспечения эффективного контроля над эпизоотическим процессом необходимо изучение вирусного, бактериального и паразитарного пейзажа, как в отдельном агропромышленном предприятии, так и на административно-хозяйственной территории в целом.
Цель проведенного исследования заключалась в изучении видового состава ассоциаций при заболеваниях респираторного тракта у молодняка крупного рогатого скота в сельскохозяйственных организациях, расположенных на единой административно-хозяйственной территории.
Материалы и методы исследования
Работа выполнена в лаборатории вирусных болезней Уральского научно-исследовательского ветеринарного института ФГБНУ УрФАНИЦ УрОРАН при поддержке программы фундаментальных исследований Уро РАН, проект 18-8-9-16 в рамках Государственного задания по направлению 160 Программы ФНИ государственных академий наук по теме № 0773-2018-0005 «Эколого-биологические особенности формирования эпизоотического процесса в зависимости от молекулярно-генетических и иммунобиологических свойств возбудителей инфекционных болезней сельскохозяйственных животных».
Объект исследования: молодняк крупного рогатого скота с заболеваниями респираторного тракта, содержащийся в 2 сельскохозяйственных организациях Красноуфимского района Свердловской области (n=108). Биопробы: кровь, сыворотка крови, фекалии, смывы со слизистых оболочек носовой полости.
Определение видового состава возбудителей проводили:
- вирусологическим методом в клеточной культуре MDBK. Учет результатов осуществляли на микроскопе Axio Observer (Zeiss, Германия);
- серологическими методами с использованием коммерческих тест-систем: «Набора эритроцитарного диагностикума для серодиагностики инфекционного ринотрахеита крупного рогатого скота в РНГА»; «Набора эритроцитарного диагностикума для серодиагностики вирусной диареи крупного рогатого скота в РНГА»; «Набора для диагностики парагриппа-3 крупного рогатого скота в РТГА» производства ООО «Агровет», г. Москва; «IDEXX Rota-Corona-K99», «Bovine Viral Diarrhoea Virus (BVDV) Antigen Test Kit/Serum Plus»; «IDEXX Neospora Ab (Neospora caninum)»; «IDEXX Chlamydia Total Ab»; «IDEXX IBR gE Ab Test»; «IDEXX IBR gB X3 Ab Test» производства IDEXX Laboratories, Inc, США. Учет результатов ИФА анализа осуществляли на ридере SUNRISE (Tecan, Австрия). Интерпретацию результатов проводили с помощью оригинального программного обеспечения xChek Assay Management System (IDEXX Laboratories Inc., США);
- бактериологическими методами: МУК 4.2.1890-04 «Методические рекомендации. Методы бактериологического исследования условно-патогенных микроорганизмов в клинической микробиологии»;
- капрологическим методом седиментационной и флотационной диагностики по Фюллеборну. Учет результатов осуществляли на микроскопе «Биолам 13» и «Микмед-5» (производство РФ).
Результаты исследования
В обследуемых популяциях молодняка крупного рогатого скота из сельскохозяйственных организаций № 1 и № 2 (СХО № 1 и СХО № 2) методами лабораторной диагностики выявлено 12 возбудителей, относящихся к разным таксономическим группам. Доминирующие положение занимали вирусы – возбудители ОРВИ и возбудители острых кишечных инфекций (ОКИ). Индекс доминирования вирусов составлял 42 % в СХО № 1 и 44,6 % в СХО № 2. Второй доминирующей таксономической группой были «Бактерии»: индекс доминирования 35 % в СХО № 1 и 33 % в СХО № 2 (рис. 1, 2).
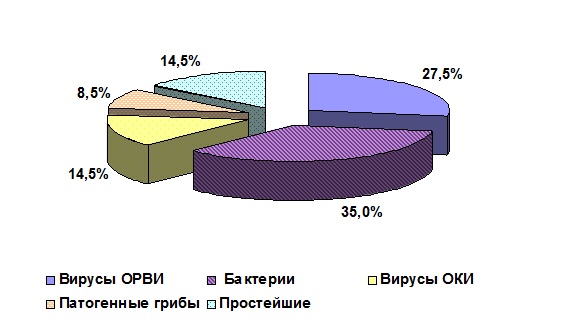
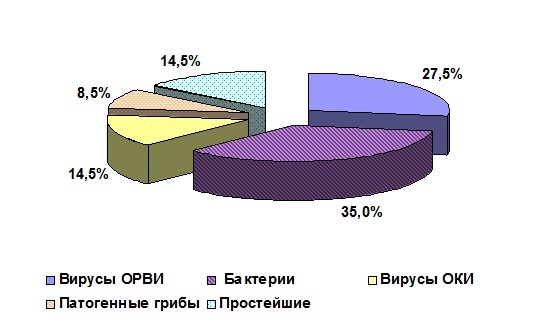
Анализ результатов исследований показал, что все выявленные возбудители диагностировались только в различных сочетаниях (ассоциациях) друг с другом.
По видовому составу ассоциаций было выделено 4 группы (рис. 3).
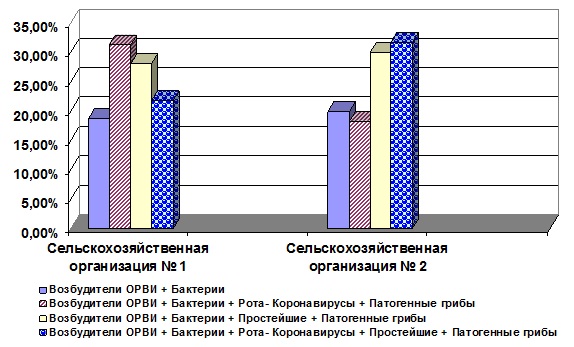
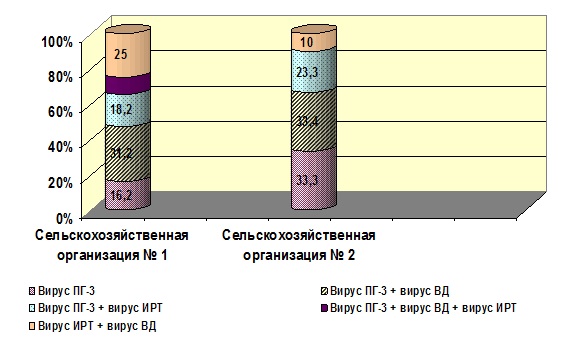
Из представленных данных видно, что подавляющее большинство ассоциаций представляют собой многокомпонентные сообщества. Характерной особенностью видового пейзажа всех групп ассоциаций было сочетанное диагностирование «Возбудителей ОРВИ +Бактерии». Доминирующим агентом в составе «Возбудителей ОРВИ» являлся вирус ПГ-3 крупного рогатого скота. Индекс доминирования вируса ПГ-3 для СХО № 1 составлял 87,5 %, для СХО № 2 – 88,3 %. Вирусы ИРТ и ВД в обследованных популяциях молодняка обнаруживались только либо совместно друг с другом, либо с вирусом ПГ-3. Однако необходимо отметить, что в популяции молодняка СХО № 1 в 9,4 % случаев одновременно диагностировали «Вирус ПГ-3 + Вирус ВД + Вирус ИРТ» (рис. 4).
Из возбудителей острых кишечных инфекций у обследованных животных Ротовирус, как самостоятельный этиологический агент, диагностировался менее чем в 2 % случаев (в СХО № 1 – 1,7 %; в СХО № 2 – 1,8 %). В 2,5 раза чаще он выявлялся совместно с Коронавирусом. В СХО № 2 Коронавирус, как самостоятельный этиологический агент, определялся в 8,9 % случаев.
Вторая доминирующая таксономическая группа «Бактерии» была представлена Streptococcus spp., Staphylococcus spp. и гемолизирующей E. coli. Микроорганизмы Streptococcus spp. и Staphylococcus spp. в биопробах от обследованных животных регистрировались в равной степени. Гемолизирующая E. coli обнаруживалась в основном совместно с Ротовирусом и/или Коронавирусом.
В видовом составе таксономической группы «Простейшие» выявлено 2 возбудителя – E. bovis и Cryptosporidium. В СХО № 1 эти возбудители диагностировались в равной степени – 7,3 % и 7,1 % соответственно. В СХО № 2 большинстве случаев в биопробах выделялись E. bovis (13,3 %), Cryptosporidium – только в 3,4 %.
Самой малочисленной таксономической группой по количеству выявленных возбудителей была группа «Патогенные грибы» (рис. 1 и рис. 2). Однако в СХО № 1 обнаружено 2 вида – Candida albicans (5,1 %) и Aspergillus (3,4 %); в СХО № 2 диагностирован 1 вид патогенных грибов – Aspergillus (5,9 %).
Заключение
Выполненные исследования показали, что существенных различий в видовом составе возбудителей при заболеваниях респираторного тракта у молодняка крупного рогатого скота СХО № 1 и СХО № 2 не обнаружено. Тем не имение, необходимо отметить, что в популяции молодняка СХО № 1 в 31 % случаев определяется антиген вируса ВД и в 26 % – вирус ИРТ. С учетом патогенетических особенностей этих возбудителей, можно предположить достаточно высокий риск формирования латентной или персистентной формы инфекции [3, 7].
При таких формах инфекции животное длительное время остается внешне здоровым, но при стрессе или беременности вирус активируется, т.е. начинает репродуцироваться в организме [3]. Животное, во-первых, становится источником инфекции, во-вторых, патологические процессы в организме протекают более стремительно, чем у первично инфицированных особей [8].
Как известно, специфических антивирусных препаратов для лечения крупного рогатого скота в настоящее время не разработано. Единственной мерой для защиты животных от ОРВИ служит вакцинопрофилактика [4, 5].
В сложившейся ситуации необходимо провести разработку индивидуальных лечебных мероприятий для каждой сельскохозяйственной организации, осуществлять постоянный контроль клинического состояния животных. По завершению курса лечебных мероприятий провести всестороннюю оценку иммуногематологического и биохимического статуса молодняка и только после этого приступать к проведению вакцинопрофилактики ОРВИ крупного рогатого скота.
Авторы
А. П. Порываева, доктор биологических наук, ведущий научный сотрудник отдела мониторинга и прогнозирования инфекционных болезней ФГБНУ «Уральский федеральный аграрный научно-исследовательский центр Уральского отделения Российской академии наук» («УрФАНИЦ УрО РАН»), Екатеринбург
И. В. Вялых, кандидат ветеринарных наук, старший научный сотрудник отдела мониторинга и прогнозирования инфекционных болезней ФГБНУ «УрФАНИЦ УрО РАН», Екатеринбург
О. Г. Томских, кандидат ветеринарных наук, старший научный сотрудник отдела мониторинга и прогнозирования инфекционных болезней ФГБНУ «УрФАНИЦ УрО РАН», Екатеринбург
Я. Ю. Лысова, научный сотрудник отдела ветеринарно-лабораторной диагностики с испытательной лабораторией ФГБНУ «УрФАНИЦ УрО РАН», Екатеринбург
Библиографические ссылки
1. Красиков А. П., Афанасенко В. И. Ассоциативные инфекционные болезни телят // Монография. Омск: Изд-во ФГОУ ВПО ОмГАУ, 2008. 275 с.
2. Лукьянова И. А. Клинико-патоморфологические особенности вирусно-бактериальных респираторно-кишечных инфекций у телят // Вестник Алтайского ГАУ. 2012. № 4 (90). С. 49–51.
3. Некоторые результаты изучения этиологии респираторных болезней телят в хозяйствах Московской области / А.В. Пчельников [и др.] // Российский ветеринарный журнал. Сельскохозяйственные животные. № 1. 2015. С. 16–18.
4. Применение инактивированной вакцины Хипрабовис-4 для профилактики ОРВИ в хозяйствах Свердловской области / Е. Н. Шилова [и др.] // Ветеринария. 2014. № 11. С. 15–17.
5. Противовирусный колостральный иммунитет и респираторные болезни у телят первого месяца жизни / Л. И. Ефанова [и др.] //Актуальные вопросы ветеринарной биологии. № 3 (19). 2013. С. 30–36.
6. Шкуратова И. А. Шилова Е. Н., Соколова О. В. Ветеринарно-санитарные аспекты профилактики болезней молодняка крупного рогатого скота в современных промышленных комплексах // Российский журнал Проблемы ветеринарной санитарии, гигиены и экологии. 2015. № 3 (15). С. 60–63.
7. Ackermann M. R. Derscheid R., Roth J. A. Innate Immunology of Bovine Respiratory Disease // Vet Clin North Am Food Anim Pract. 2010. 26 (2). P. 215–228.
8. Shilova E. N., Vyalykh I. V. Clinical implications of bovine viral diarrhoea in breeding enterprises of the Ural region // Science & Education. 2013. Vol. 22. № 1. P. 179–182.
9. Single Pathogen Challenge with Agents of the Bovine Respiratory Disease Complex/ L.J. Gershwin [et al.] // PLoS One.2015. 10(11) (указать номера страниц).
10. The epidemiology of bovine respiratory disease: What is the evidence for predisposing factors / J. D. Taylor [et al.] // Can Vet J. 2010. № 51. P. 1095–1102.

