Колостральный иммунитет – уникальная, эволюционно сформированная система механизмов защиты и адаптации новорожденных теплокровных особей в ранний неонатальный период.
Формирование колострального иммунитета у человека и животных происходит под контролем и с помощью иммунной системы матери. «Передача» клеток иммунной системы и иммунологических факторов от матери к новорожденному осуществляется посредством молозива [2, 3, 7, 10].
В многочисленных исследованиях было доказано, что молозиво является самым мощным природным иммуномодулятором и иммунопротектором [5, 6, 8]. Иммуномодулирующие свойства молозива обеспечивают содержащиеся в нем иммунокомпетентные клетки (нейтрофилы, моноциты, базофилы, лимфоциты) и цитокины. Так, например, установлено, что после выпойки молозива в крови новорожденного теленка количество Т-лимфоцитов увеличивается в среднем на 20–25 %, в лимфоидных тканях кишечника – на 70–72 %. Таким образом, лимфатическая система новорожденного теленка активируется и подготавливается к «приему» иммунной информации. Аналогично «запускаются и активируются» механизмы фагоцитоза. Начальный этап взаимодействия клеток иммунной системы новорожденного обеспечивают цитокины, содержащиеся в молозиве матери [2, 6, 8, 10, 13].
Иммунопротективное (защитное) действие молозива осуществляется через гуморальные факторы, и в первую очередь через иммуноглобулины. В составе молозива коровы присутствуют все классы иммуноглобулинов – JgA, JgG, JgD, JgE и JgM. В крови новорожденного теленка иммуноглобулины отсутствуют, что обусловлено морфоструктурой плаценты коровы-матери, препятствующей поступлению крупномолекулярных глобулинов в кровяное русло плода [4, 5, 8]. Иммуноглобулины в организм новорожденного теленка поступают при выпаивании молозива. В первые сутки после родов в молозиве в наибольшем количестве содержатся JgA до 43 г/л и JgG – до 52 г/л. Поступающие с молозивом иммуноглобулины A выполняют защиту слизистых оболочек пищеварительного тракта и индуцируют развитие местного иммунитета. Иммуноглобулины G являются основным фактором защиты новорожденного в ранний постнатальный период, когда происходит физиологическое «созревание» иммунной системы [2, 7, 11]. Полученные через молозиво материнские JgG создают основу колострального (пассивного) иммунитета у теленка.
Материнские JgG – это антитела к антигенам, которыми иммунизировали корову-мать, а также антитела к антигенам, которые встречаются в окружающей среде. Кроме своего строго специфического действия JgG обладают опсонизирующей активностью по отношению к возбудителям с более или менее близкими антигенными структурами, то есть способны выполнять функцию «распознавания» и индуцировать фагоцитоз даже против тех возбудителей, с которыми корова-мать не контактировала [2, 10].
Напряженность колострального иммунитета напрямую зависит от уровня всасывания материнских иммуноглобулинов через слизистую оболочку кишечника новорожденного теленка. В многочисленных исследованиях доказано, что самое интенсивное всасывание глобулинов происходит в первые 6–12 часов после рождения, при этом не происходит изменений в их структуре и иммунобиохимических свойствах. Авторы исследований особо подчеркивают, что чем раньше новорожденный теленок получит первое молозиво, тем большее количество иммуноглобулинов поступит в его кровоток. Поэтому настоятельно рекомендуют выпаивать первое молозиво теленку не позднее 1,5 часов после рождения [3, 5, 6, 9].
Время действия колострального иммунитета обусловлено периодом полураспада циркулирующих в кровотоке иммуноглобулинов: для JgA он составляет 4–6 суток, для JgG – 10–21 сутки. Как правило, защитное действие колострального иммунитета у теленка заканчивается к месячному возрасту. Однако параллельно с редукцией колостральных иммуноглобулинов у теленка с 2-х недельного возраста активно развивается адаптационный иммунитет [2, 8, 9, 11, 13].
Одной из актуальных проблем ветеринарной науки и практики является защита поголовья крупного рогатого скота от острых респираторных вирусных инфекций (ОРВИ). В исследованиях российских и зарубежных авторов показано, что основная группа животных, наиболее подверженная заражению ОРВИ – это молодняк крупного рогатого скота в возрасте до 3 месяцев [4, 7, 12]. В настоящее время единственным фундаментально проработанным методическим приемом специфической профилактики и борьбы с ОРВИ крупного рогатого скота остается вакцинация. Разработаны как инактивированные, так и живые вакцины против основных возбудителей ОРВИ крупного рогатого скота – вируса парагриппа 3 типа (ПГ-3), вируса инфекционного ринотрахеита (ИРТ), респираторно-синцитиального вируса (РСИ) и вирусной диареи (ВД). Однако активная иммунизация молодняка крупного рогатого скота, особенно поликомпонентными вакцинами, рекомендуется не ранее 21–28 дневного возраста [4, 7]. До достижения данного возраста только полноценный колостральный иммунитет может обеспечить защиту теленка от ОРВИ.
Цель проведенного нами исследования заключалась в оценке напряженности колострального иммунитета у телят к возбудителям ОРВИ крупного рогатого скота.
Материалы и методы исследований
Исследования выполнены в лаборатории вирусных болезней Уральского научно-исследовательского ветеринарного института ФГБНУ «УрФАНИЦ УрО РАН» в рамках Государственного задания по направлению 160 Программы ФНИ государственных академий наук по теме № 0773-2018-0001 «Разработка теоретических основ для создания и внедрения программы мониторинга, диагностики, лечебно-профилактических и оздоровительных мероприятий по защите животных от эпизоотически значимых инфекционных болезней».
Объект исследования: телята в возрасте до 1 месяца в условиях одной сельскохозяйственной организации (n=50). Предмет исследования – пробы сыворотки крови телят. Для оценки напряженности колострального иммунитета к возбудителям ОРВИ пробы крови у новорожденных телят отбирали после выпаивания им молозива (1 сутки после рождения), затем на 10-е, 20-е и 30-е сутки. В период наблюдения также проводили анализ уровня заболеваемости телят.
Определение титра антител к вирусу ИРТ в пробах сывороток крови крупного рогатого скота проводили в реакции непрямой гемагглютинации (РНГА) по ТУ-10-19-327-92 с использованием «Набора эритроцитарного диагностикума для серодиагностики инфекционного ринотрахеита крупного рогатого скота в РНГА» производства ООО «Агровет», г. Москва. В соответствии с методическими указаниями производителя диагностического набора положительными считали сыворотки крови, в которых титр антител был выше или равен 1:4.
Определение титра антител к вирусу ВД в пробах сывороток крови крупного рогатого скота проводили в реакции непрямой гемагглютинации (РНГА) с использованием «Набора эритроцитарного диагностикума для серодиагностики вирусной диареи крупного рогатого скота в РНГА» производства ООО «Агровет», г. Москва. В соответствии с методическими указаниями производителя диагностического набора положительными считали сыворотки крови, в которых титр антител был выше или равен 1:8.
Определение титра антител к вирусу ПГ-3 в пробах сывороток крови крупного рогатого скота проводили в реакции торможения гемагглютинации (РТГА) по ТУ-10-19-84-89 с использованием «Набора для диагностики парагриппа-3 крупного рогатого скота в РТГА» производства ООО «Агровет», г. Москва. В соответствии с методическими указаниями производителя диагностического набора положительными считали сыворотки крови, в которых титр антител был выше или равен 1:16.
Для оптимизации выполнения статистической обработки полученных результатов титры антител выражали в значениях логарифма по основанию 2 – log2.
Достоверность результатов подтверждали путем статистической обработки данных с использованием программы Microsoft Excel, входящей в пакет программ Microsoft Office Pro.
Результаты исследования
В сельскохозяйственной организации для профилактики и защиты поголовья крупного рогатого скота от ОРВИ применялась вакцина «Комбовак» (производства ООО «Ветбиохим», г. Москва). В соответствии с «Инструкцией по применению вакцины «Комбовак» коровы-матери, обследуемых телят, были ревакцинированы за 60 суток до предполагаемых родов.
Серологический скрининг сывороток крови новорожденных телят после выпаивания молозива показал, что антитела к возбудителям ИРТ, ВД и ПГ-3 определялись во всех пробах. Однако титры антител к возбудителям ОРВИ существенно различались.
У 42 телят (84 %) диагностировали высокий уровень специфической невосприимчивости (напряженность иммунитета) в отношении возбудителей ОРВИ. У 27 из них (54 %) титр антител к вирусу ИРТ составлял от 1:32 до 1:64, к вирусу ВД – от 1:32 до 1:64, к вирусу ПГ-3 – от 1:128 до 1:256. У 30 % телят количество антител в пробах сыворотки было несколько ниже: титр антител к вирусу ИРТ – от 1:8 до 1:16, к вирусу ВД – от 1:8 до 1:16, к вирусу ПГ-3 – от 1:32 до 1:64. В соответствии с методическими указаниями производителя диагностических наборов выявленные титры антител к возбудителям ОРВИ регистрируются как «протективные», то есть защитные. Такой уровень антител в сыворотке крови телят свидетельствует, во-первых, об эффективности вакцинопрофилактики ОРВИ у коров-матерей, во-вторых, о своевременном выпаивании молозива этим животным. Для изучения динамики изменения уровня колостральных антител эти телята были объединены в «группу 1».
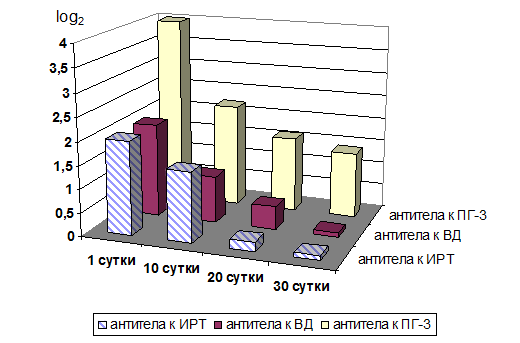
В 16 % случаев у телят выявлялись антитела на уровне «положительных» значений, то есть количественное содержание специфических иммуноглобулинов в сыворотке крови было предельно низким. Так титр антител к вирусу ИРТ составлял 1:4, к вирусу ВД – 1:4, к вирусу ПГ-3 – 1:16. С учетом периода полураспада специфических иммуноглобулинов, который составляет 10 суток, антитела в таких титрах не способны обеспечивать защиту организма теленка от ОРВИ [1, 2, 11]. Хотя некоторые исследователи считают, что «положительные» значения титра антител к возбудителям оказывают определенное протективное действие и способны инициировать развитие адаптативного иммунитета [3, 4, 13], по нашему мнению, следует относить этих животных к «группе повышенного риска» по вероятности их заражения респираторными вирусами («группа 2»).
Результаты определения уровня колостральных антител к возбудителям ОРВИ у телят на 10-е, 20-е и 30-е сутки представлены на рисунках 1 и 2.
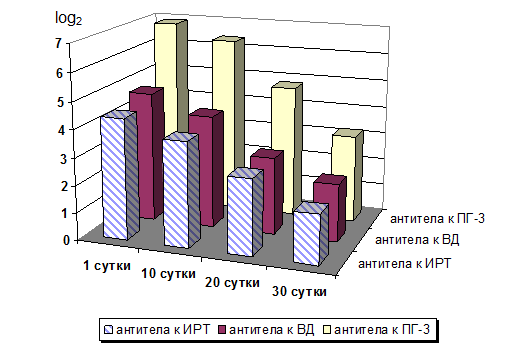
Как видно из представленных диаграмм, у телят к месячному возрасту антитела к возбудителям ОРВИ диагностировались в «следовых» количествах, что соответствовало классической теории о периоде действия колострального иммунитета [2, 7, 10]. Однако динамика снижения уровня напряженности колострального иммунитета у обследованных телят существенно различалась. Так, у животных с высоким «фоновым» уровнем колострального иммунитета – группа 1 (рис. 1) в сыворотке крови к 20-ым суткам титры антител к возбудителям ОРВИ определялись как «протективные» (защитные).
У телят с низким «фоновым» уровнем колострального иммунитета – группа 2 (рис. 2) уже к 10-ым суткам количество антител в сыворотке крови было минимальным, не способным обеспечить полноценную противовирусную защиту. То есть фактически с первой недели жизни эти телята представляли собой своеобразную «мишень» для заражения не только возбудителями ОРВИ, но и другими инфекционными агентами.
Анализ данных формы 1-Вет показал, что в течение 1-го месяца жизни 28 % обследуемых телят перенесли различные заболевания (рис. 3).
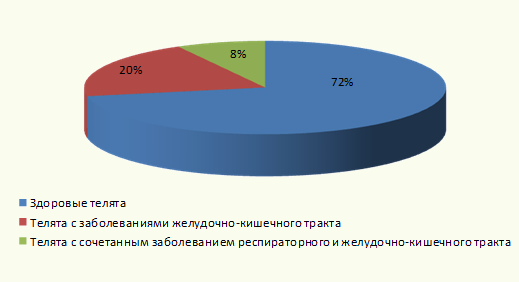
В период наблюдения у 20 % телят заболевания желудочно-кишечного тракта характеризовались диспепсическими расстройствами. По данным, предоставленным сельскохозяйственной организацией, заболевание было обусловлено нарушениями микробиоценоза кишечника. В 8 % случаев зарегистрировано сочетанное заболевание: респираторная симптоматика и диспепсия. Необходимо отметить, что в группе 1 из 42 телят желудочно-кишечными расстройствами переболело 6 животных, респираторной симптоматики у них не наблюдалось. В группе 2 желудочно-кишечными расстройствами переболели все животные (8 голов), при этом у половины телят (4 головы), заболевание сопровождалось серозным и гнойно-серозным ринитом.
Выводы
Проведенные исследования показали, что оценка напряженности колострального иммунитета у телят является одним из ключевых звеньев в разработке эффективных программы защиты молодняка в ранний неонатальный период от ОРВИ крупного рогатого скота.
- Основным критерием для включения новорожденного теленка к «группе повышенного риска» по вероятности заражения респираторными вирусами служит предельно низкое содержание специфических иммуноглобулинов в сыворотке крови: титр антител к вирусу ИРТ ≤1:4, к вирусу ВД ≤1:8, к вирусу ПГ-3 ≤1:16.
- В постнатальный период развития теленка из «группы повышенного риска» необходимо обратить особое внимание на проведение лечебно-профилактических мероприятий, направленных в первую очередь на коррекцию колострального иммунитета против ОРВИ крупного рогатого скота. Во-вторых, на профилактику желудочно-кишечных заболеваний.
Библиографические ссылки
1. Значение серологического скрининга для определения напряженности поствакцинального иммунитета к возбудителям ОРВИ у молодняка крупного рогатого скота / А. П. Порываева, Е. Н. Шилова, В. Р. Нурмиева, И. В. Устьянцев // Аграрная наука Евро-Севера-Востока. 2017. № 6. С. 41–45.
2. Кокряков В. Н. Очерки о врожденном иммунитете. СПб.: Наука, 2006. 261 с.
3. Колостральный иммунитет и иммунопрофилактика болезней новорожденных телят / Ю.Н. Федоров, В.И. Клюквина, О.А. Богомолова, М.Н. Романенко // Ветеринария. 2016 № 5. С. 3–7.
4. Концевая Н. Н. Разработка вакцин против инфекционного ринотрахеита, вирусной диареи, рота- коронавирусной болезней и лептоспироза крупного рогатого скота :дисс. … канд. вет. Наук. Москва, 2016. 137 с.
5. Корякина Л. П. Особенности клеточного состава молозива коров в первые сутки лактации // Достижение науки и техники АПК. 2011. № 2. С. 54–55.
6. Малашко В. В., Кузнецов Н. А. Иммуноглобулины молозива. Гродно: ГГАУ. 2010. 98 с.
7. Сергеев В. А. Непоклонов Е. А., Алипер Т. И. Вирусы и вирусные вакцины. М.: Библионика, 2007. 524 с.
8. Скопичев В. Г., Яковлев В. Г. Частная физиология. Физиология продуктивных животных. Часть 2. М.: «Колос», 2008. 555 с.
9. Соколова О. В. Зайцева О. С., Белоусов А. И. Характеристика иммунного статуса высокопродуктивных коров и его влияние на формирование иммунной системы молодняка / В сборнике: современные проблемы и инновационные подходы к диагностике, лечению и профилактике болезней животных и птиц. Экологические проблемы использования природных и биологических ресурсов в сельском хозяйстве. Материалы международной научно-практической конференции. Екатеринбург, 2012. С. 214–217.
10. Хаитов Р. М. Игнатьев Г.А., Сидорович И.Г. Иммунология. Норма и патология. М.: Медицина, 2010. 750 с.
11. Шилова Е. Н. Колостральный иммунитет у телят при вакцинации коров-матерей против ОРВИ // Аграрный вестник Урала. 2011. № 8. С. 30–31.
12. Шкуратова И. А., Шилова Е. Н., Соколова О. В. Ветеринарно-санитарные аспекты профилактики болезней молодняка крупного рогатого скота в современных промышленных комплексах // Проблемы ветеринарной санитарии, гигиены и экологии. 2015 № 3 (15). С. 60–63
13. Шульга Н. Н., Петрухин М. А., Желябовская Д. А. Некоторые аспекты формирования колострального иммунитета у новорожденных животных // Вестник КрасГАУ. 2012 № 8. С. 136–138.
Авторы:
А. П. Порываева, доктор биологических наук, ведущий научный сотрудник отдела мониторинга и прогнозирования инфекционных болезней, ФГБНУ «Уральский федеральный аграрный научно-исследовательский центр Уральского отделения Российской академии наук» («УрФАНИЦ УрО РАН»), Екатеринбург
И. А. Шкуратова, доктор ветеринарных наук, профессор, главный научный сотрудник, директор ФГБНУ «УрФАНИЦ УрО РАН», Екатеринбург
О. В. Соколова, старший научный сотрудник, кандидат биологических наук, «УрФАНИЦ УрО РАН», Екатеринбург

